Bajo este sugerente título, resultado de un ligero cambio en una frase del poeta y novelista Valeriu Butulescu, comienza este post sobre… ¡el jabón! Aprovechemos para explicar la química de este objeto tan necesario como cotidiano, que tenemos en nuestras cocinas y baños, y con el cual limpiamos de grasa nuestro cuerpo, cabello y manos.
La grasa es hidrófoba. Esta característica hace que sea extremadamente difícil de disolver en compuestos polares como el agua. Por este motivo, eliminar la grasa en presencia únicamente de agua es complicado. Como seguro habréis comprobado en alguna ocasión, es necesaria una tercera sustancia en cuestión: el jabón. Una sustancia que actúa como buen “mediador”, poniendo solución al conflicto que muestran entre sí la grasa y el agua.
Jabón y su espuma
.
¿Cómo funcionan?
Los jabones tienen en su estructura dos partes: una hidrófoba “amiga” de la grasa y una parte hidrófila “compañera” del agua.
— La parte hidrófoba está constituida por una larga cadena hidrocarbonada. Esta naturaleza química prácticamente apolar hace que se mezcle íntimamente con la grasa.
— La parte hidrófila está situada en uno de los extremos de la cadena anterior y está compuesta por una sal de ácido carboxílico. Al humedecer el jabón, la sal se disocia y la elevada polaridad resultante hace que muestre gran afinidad por el agua.
.
¿Qué ocurre entonces?
El jabón se dispone formando una corona circular denominada micela. Hacia su interior se disponen las cadenas hidrocarbonadas, apolares, que acogen la grasa la cual queda protegida del agua. Por su parte, los extremos polares de las mismas, hidrófilos y por tanto hidrosolubles, son afines al agua formando con él interacciones intermoleculares fuertes, y constituyendo de este modo, el exterior de la corona en contacto con el agua. De este modo, las grasas son separadas de la superficie donde están (piel, tejido textil…) y arrastradas por el agua.
.
Viendo lo importantes que son en nuestra vida cotidiana, ¿cómo se fabrican?
Los jabones se producen a través de la reacción de saponificación por la cual, una grasa (un conjunto de ácidos grasos) reacciona con una base (sosa, potasa…) para dar lugar al jabón como producto principal y obteniendo como subproducto de la reacción glicerina o similar. Es necesaria una correcta agitación, y, en ocasiones, calentar. Veamos en la siguiente imagen dicha reacción:
Saponificación: grasa + base → jabón + glicerina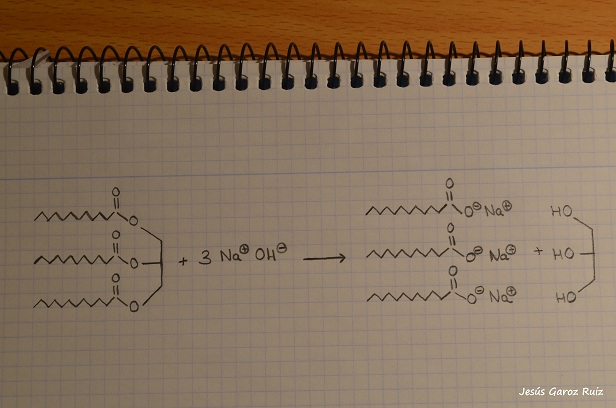
Podemos observar como una grasa, concretamente el triacilglicérido formado por tres moléculas de ácido graso (concretamente el ácido láurico), reacciona con una base en medio acuoso para dar lugar a tres sales de sodio del ácido laúrico (lauratos de sodio) generándose, como subproducto, la glicerina o glicerol.
Como no podía ser de otra forma, el tipo de ácido graso es determinante para las propiedades del jabón. Tenemos dos tipos principales:
– Ácidos grasos saturados: no poseen dobles enlaces. Por lo tanto, forman cadenas extendidas con destacadas fuerzas intermoleculares de Van der Waals entre ellas. En consecuencia, son grasas sólidas, duras. Algunos ejemplos son el ácido laúrico (12 C), mirístico (14 C), palmítico (16 C), esteárico (18 C) o el lignocérico (24 C).
– Ácidos grasos insaturados: poseen dobles enlaces C=C de tipo generalmente “cis”. Éstos originan acentuadas curvaturas estructurales que producen una disminución de las fuerzas de Van der Waals. Por tanto, suelen ser líquidos a temperatura ambiente. Algunos ejemplos son el ácido palmitoleico (16 C), oleico (18 C), linoleico (18 C) o el araquidónico (20 C).
Según el ácido graso, los jabones pueden tener diversos orígenes, tanto animales (mantecas), como generalmente vegetales (de coco). El tipo de ácidos grasos usados influye en el jabón, haciendo jabones duros o blandos. El coco, por ejemplo, crea jabones duros. El de aceite de oliva o de almendra, jabones blandos. Pero también hay muchos más aspectos que controlar. Por ejemplo, los jabones de ácidos grasos con doce o menos átomos de carbono resultan ser más ácidos que los fabricados con ácidos grasos con más átomos de carbono, por lo que aunque limpien bien, nos pueden resecar y estropear las manos, pues no olvidemos que éstas tienen una capa de grasa natural en la piel.
Este post participa en la Edición del Cu del Carnaval de Química, cuyo anfitrión es Héctor Busto en su blog «Más ciencia, por favor».



























Habrá personas como yo que nos preguntemos después de esto y al mirra la foto ¿por qué hacen espuma los jabones? o por ejemplo ¿por qué hablamos unas veces de jabones y otras de detergentes, no es lo mismo? Aprender nos hace reflexionar, claro!
¡Hola Arantza!
¡Qué ilusión leerte por aquí, siempre tan atenta en todo!
Muy buena apreciación. Casi da para hacer otro post… ;-)
Así a grandes rasgos… La espuma viene dada por la formación de bolsas de aire en las estructuras comentadas a lo largo del post. Es prácticamente todo aire, al haber disminuido la tensión superficial del agua.
Por otro lado, aunque los jabones y detergentes sean surfactantes, no son lo mismo. Los detergentes son mezclas más complejas que el jabón. Mientras los jabones tienen como parte polar el grupo carboxilo ionizado, los surfactantes de los detergentes suelen poseer el grupo sulfonato. Además, los detergentes suelen estar formados por diferentes mezclas de surfactantes que permiten que actúen mejor que los jabones en aguas duras. Y como bien sabemos, incorporan agentes coadyuvantes para blanquear manchas y otros agentes complementarios para arrastrar restos orgánicos y blanqueantes de tejidos que exaltan la limpieza.
Pero seguro que tú, Arantza, puedes explicar mucho más de esto que yo ;-)
Un abrazo, me alegro que visites moles de química,
Jesús